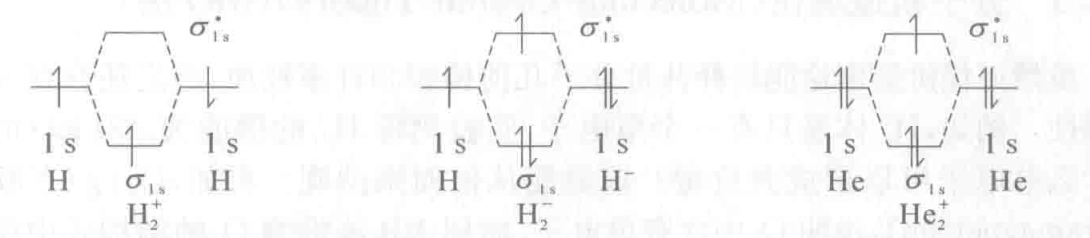注:非化竞生,不保证正确性。
原子结构
四个量子数
主量子数
代表电子大层,取值为正整数。
越大,表明电子能级或主能级层的能量越大,也表示电子离核的平均距离越大。
角量子数
取值为 。
代表电子亚层,电子在空间中的运动形式,用 表示。
磁量子数
取值为 。
代表亚层中轨道的数目。原子轨道在空间中的不同取向。
自旋量子数
前面三个量都是薛定谔方程解出来的,但是实验发现氢原子在不均匀磁场中,电子由 跃迁到 时,得到两条靠的很近的普贤,说明电子还存在其它的运动形式。
,每个轨道中只能容纳两个电子。
原子的能级
分子结构
一根单键相当于共用一对电子,相当于两对电子。
于是 \ce{NO3-} 的 \ce{N} 不能连 5 根键,这样就有 10 个电子了。
元素的氧化数和成键数是两个不同的概念,注意区分。
杂化理论
杂化的判定
\ce{BF3},\ce{NF3} 的杂化类型,前者为平面三角型,后者有一对孤对电子,于是成三角锥形。
杂化轨道的形状
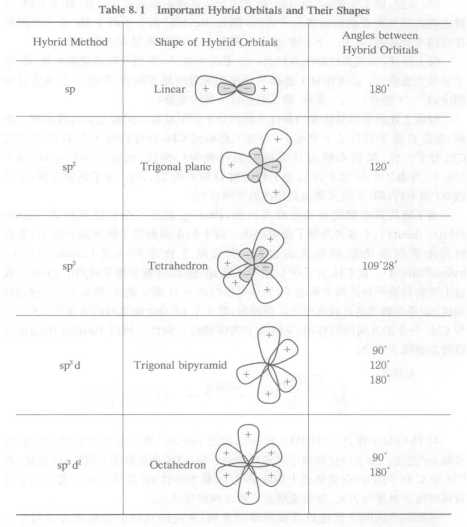
从上到下依次为:
直线型,平面三角型,正四面体型,三角双锥型,正八面体。
举例
\ce{PCl3}
一对孤对电子,三角锥形。
\ce{PCl5}
三角双锥型。
\ce{PCl6-}
正八面体型。
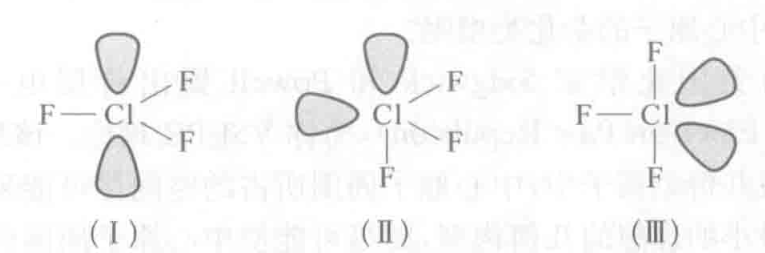
\ce{ClF3}
两对孤对电子,怎么排布。
反正是列表比较,孤对-孤对>孤对-成键>成键-成键,所以是 那种。
称为 型分子。
HXC 说孤对电子排斥力随键角减小指数级增长,所以 180 几乎为 0,120 增长一点,到 90 就增长了很多。
\ce{I3-}
线性的分子,\ce{sp^3d} 杂化。
\ce{SCl4}
一对孤对电子,\ce{sp^3d} 杂化,呈现跷跷板型。
\ce{XeF2}
还剩三对孤对电子,直线型。
\ce{IF5}
一对孤对电子,\ce{sp^3d^2} 杂化,呈现四方锥型。
\ce{XeF4}
两对孤对电子,和 \ce{ICl3} 不同,放在两侧(因为 90 度排斥力显著大于 120 度……)
所以是平面正方形。
小知识点
为什么 \ce{(SiH3)N} 是平面三角型
因为 N 的孤对电子可以和 \ce{Si} 的 \ce{3d} 空轨道形成大 键。
键之间的排斥力
双-双>双-单>单-单,于是可以解释 \ce{C2H4} 的键角。
孤对电子的排斥力
\ce{PH3} 的 \ce{P-H} 键的键角小于 \ce{NH3} 的 \ce{N-H} 键的键角,是因为 \ce{P} 具有 \ce{3p} 的孤对电子,体积大于 \ce{N} 的 \ce{2p} 电子。
也可以用电负性解释,\ce{P-H} 的键长大于 \ce{N-H} 键长。(有点牵强)
离域 键
定域键是指两个原子之间共享电子形成的共价键,而离域键是指 3 个及以上的原子形成的共价键。
符号表示为 为轨道数, 为电子数。
最好 ,如果 则不形成大 键。
这个可以用分子轨道理论解释,键级=(成键电子-反键电子)/2,容易看出在 时成键电子对数=n,键级为 n/2 达到最大值,最稳定,而 成键电子=反键电子,键级为 0。
最为常见……
分子轨道理论